真菌感染是造成临床免疫功能低下和缺陷病人死亡的重要原因,目前临床可用的抗真菌药物仅有康唑类等少数几种,且较易产生耐药性。激活和增强宿主固有免疫反应来抵抗真菌感染将为临床治疗提供一个新的途径。免疫细胞表面的模式识别受体 (PRR) 可识别病原微生物所特有的保守分子模式 (PAMP) 引起一系列免疫反应,而 C 型凝集素受体 (C-type lectin Receptor) 在抗真菌免疫反应中发挥重要作用。之前的研究发现 Dectin-1、-2、-3 等 C 型凝集素受体可识别真菌表面的α甘露聚糖和β葡聚糖激活 NF-κB 依赖的促炎信号来介导机体抵御真菌感染,而其它 C 型凝集素受体在真菌感染免疫反应中的作用机制尚不明确。
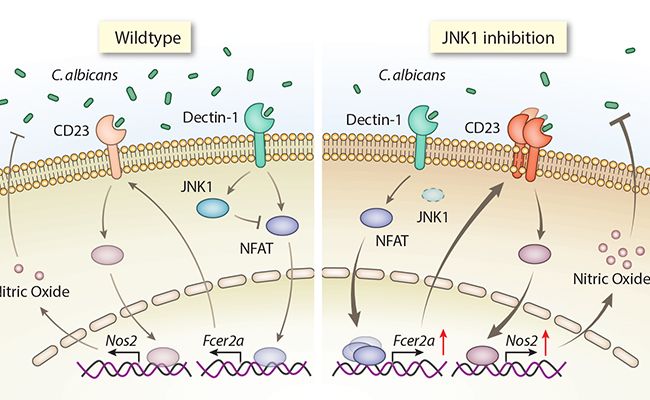
JNK1 通过 C 型凝集素受体 CD23 负调控抗真菌免疫反应的分子机制模型。
清华大学医学院林欣实验室在近日在《自然 医学》杂志上在线发表题为《JNK1 通过抑制 C 型凝集素受体 CD23 负调控抗真菌天然免疫反应》(JNK1 negatively controls antifungal innate immunity by suppressing CD23 expression) 的学术论文中发现,JNK1 基因敲除小鼠在临床上最为常见的深部真菌感染、白色念珠菌感染后,其生存率相对于野生型对照小鼠明显增加,同时在野生型小鼠中应用 JNK 抑制剂后小鼠对于深部真菌感染的生存率也显着增加。其具体机制为,巨噬细胞表面 C 型凝集素受体 Dectin-1 识别酵母态的真菌,激活胞内 NF-κB、NFAT 等信号;当 JNK1 基因敲除或表达被被抑制情况下,转录因子 NFATc1 活性增强,NFATc1 可结合到 C 型凝集素受体 CD23 的启动子区显着上调其表达;高表达的 CD23 可以识别真菌细胞壁表面成分α甘露聚糖和β葡聚糖,并介导巨噬细胞分泌更多的一氧化氮来杀伤真菌。重要的是,两种 JNK 抑制剂 SP600125 和 JNK-IN-8 在动物模型和细胞水平都显示出了良好的抗真菌感染治疗效果。这些发现首次从分子和动物机体水平明确揭示了 JNK1 负调控抗真菌感染的作用机制,揭示了 JNK1 可作为一个潜在的 “药物靶点”,通过抑制 JNK1 的功能来增强机体抗真菌的天然免疫反应用于临床深部真菌感染的治疗。
 基因君官网
基因君官网