2017年10月27日/基因宝jiyinbao.com/—本期为大家带来的是CRISPR-CAS9技术的最新研究进展,希望读者朋友们能够喜欢。
doi/10.1073/pnas.1706193114

最近,来自爱荷华大学的研究者们利用CRISPR-CAS9基因编辑技术破坏了一个与某种类型的青光眼疾病相关的突变基因,这种类型的青光眼是永久性致盲的主要原因之一。
在这项研究中,作者以青光眼小鼠模型作为研究对象,并且利用CRISPR-CAS9技术将突变的肌纤蛋白进行了敲除。肌纤蛋白的突变是引发青少年与成年人的广角青光眼的主要因素。研究者们发现通过敲除这一蛋白能够阻止青光眼对眼部的损伤。
“作为科学家,我们不仅仅希望发现一种与疾病相关的基因而且需要理解基因的具体工作机制。对这一具体的例子来说,我们希望对该基因进行更加深入的理解,从而提高疾病的治疗效果”,该研究的作者,来自爱荷华大学分子遗传学习的主任Val Sheffield博士说道:“在此之前,还没有人知道该基因的具体工作方式,仅仅知道该基因的突变能够引发青光眼”。
相关结果发表在最近一期的《PNAS》杂志上。
青光眼是最常见的视力与神经退行性疾病。40岁以上的人群中有3%-5%会受到影响。
肌纤蛋白是小梁骨架组织(负责调节眼压的结构)的组成成分,该基因的突变会导致眼部压力的升高。研究者们利用基因编辑技术破坏了突变的肌纤蛋白的功能,进而缓解了小鼠患青光眼的症状。这一发现对于治疗人类青光眼或许具有重要的意义。
doi:10.1007/s13238-017-0475-6
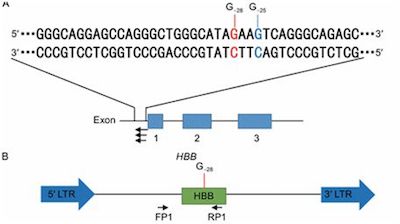
2015年4月,来自中国中山大学生命科学学院的黄军就(Junjiu Huang)副教授、松阳洲(Zhou Songyang)教授及其研究团队首次利用最新的基因组编辑技术CRISPR/Cas9对人胚胎中会导致地中海贫血的β珠蛋白基因突变成功地进行修饰。他们希望利用这种技术对这种基因突变进行校正,以便实现利用基因疗法治疗地中海贫血(Protein & Cell, doi:10.1007/s13238-015-0153-5)。这一研究成果受到国内许多科学家的赞扬,但却在西方引起激烈的争议和批评,即便他们使用的医院丢弃的不会成功孕育出婴儿的异常胚胎。
如今,黄军就副教授、松阳洲教授与中山大学附属第一医院生殖医学中心主任周灿权(Canquan Zhou)教授合作再次利用CRISPR对人胚胎进行编辑—这一次,他们对这种技术进行改进实现碱基编辑,这种基因组编辑方法要比传统的CRISPR-Cas9技术更加高效地校正点突变。他们成功地对导致β-地中海贫血的一种单核苷酸错误进行校正。相关研究结果于2017年9月23日在线发表在Protein & Cell期刊上,论文标题为“Correction of β-thalassemia mutant by base editor in human embryos”。
尽管所产生的胚胎是嵌合的,也就是说,它们含有得到校正的细胞和未得到校正的细胞,但是这种技术比之前的方法有潜力实现更高精准的编辑。
英国肯特大学遗传学家Darren Griffin(未参与这项研究)说,“这篇论文本身就代表了一项重大的技术进步。当前的这种‘碱基编辑器’技术是对之前报道的传统CRISPR技术进行改进,而能够通过化学方式改变DNA碱基本身。”
与旧有的基因编辑技术不同的是,这种碱基编辑技术在进行编辑时并不切割DNA,这一特征使得它产生更少的有害的副作用。为了在人体中测试这种方法,来自中山大学的这些研究人员利用来自一名β-地中海贫血患者的组织构建出克隆胚胎。β-地中海贫血是一种潜在地危及生命的血液疾病,它在全世界的患病率大约是10万分之一。在此之前,人们在不断地尝试着利用基于CRISPR的方法根除导致这种疾病的致病性突变。
这些研究人员随后对这些胚胎中的DNA进行了扫描,发现一种单核苷酸错误,即应当为A的碱基被替换为G,接着利用这种碱基编辑技术将这种碱基转换回去,即实现G→A。尽管他们在论文中承认在将这种技术能够人体治疗之前,还需进一步开展研究,但是黄军就副教授说,“我们是首次证实利用这种碱基编辑器系统治愈人类胚胎中的遗传疾病是可行的。”
就在这项新的研究发表几周前,来自美国和韩国的研究人员已报道利用CRISPR-Cas9成功地校正人胚胎中导致心脏病的MYBPC3基因突变,具体而言就是MYBPC3基因突发生的仅4个碱基对的小缺失(Nature, doi:10.1038/nature23305)。这一项目被誉为是第一项对有活力的人类胚胎进行编辑的研究,但是很快就遭到了其他研究人员的批评:这项研究的作者们对这些数据的解读是存在问题的。
doi:10.1126/science.aah7084
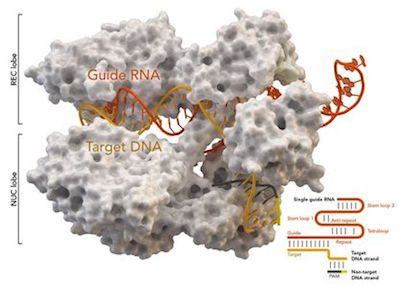
在一项新的研究中,来自瑞典乌普萨拉大学的一个研究小组发现被称为“分子剪刀(molecular scissors)”的CRISPR-Cas9如何能够在基因组中寻找特定的DNA序列。Cas9已经在生物技术领域有了很多应用,也有望给医学带来革命性的变化。这些研究发现表明如何改进Cas9使得这种分子剪刀变得更加快速和更加可靠。相关研究结果发表在2017年9月29日的Science期刊上,论文标题为“Kinetics of dCas9 target search in Escherichia coli”。
在不到十年的时间里,CRISPR-Cas9已引发生物研究变革。为了特定的目的,Cas9使得校正或修饰(“编辑”)任何DNA序列成为可能。人们希望这种分子剪刀也能够治愈和阻止遗传疾病。
Cas9的一个令人兴奋的方面是能够利用一段人工遗传密码对这种分子进行编程,这样就能够在基因组中寻找相应的序列。如今,这个研究小组发现了Cas9如何找到正确的序列。
论文通信作者Johan Elf说,“大多数寻找DNA密码的蛋白能够仅通过检测DNA双螺旋的外面来识别特定的序列。Cas9能够搜索任何一种DNA密码,但是要确定这种分子是否位于合适的位点上就必须打开DNA双螺旋,将寻找到的序列与编程的密码进行比较。令人难以置信的是,它能够搜索整个基因组,而且不需要使用任何能量。”
这些研究人员开发出两种新的方法来测量Cas9找到它的靶序列需要多长时间。第一种方法表明Cas9花6个小时的时间搜索细菌基因组(400万个碱基对)。这种有点不可能的结果也能够通过第二种独立的方法加以验证。所发现的这种时间也与Cas9用来测量每个位点花费的毫秒数(能够通过实时地追踪标记的Cas9分子加以测量)相吻合。
Elf说,“这些结果表明Cas9为它的灵活性付出的代价是时间。为了更快速地发现靶序列,需要更多的Cas9分子寻找相同的DNA序列。”
在合理的时间范围内发现正确的序列所需的高浓度Cas9能够给科学家们试图替换的细胞带来严重的问题。但是,鉴于如今这种搜索过程的性质得到理解,关于如何能够改进这种系统的一种重要的线索已被发现。通过牺牲Cas9的一部分灵活性,人们就有可能设计出仍然具有多功能性的分子剪刀,它们能够编辑多种基因,但是同时也足够快而可以在医学上使用。
Elf说,“这些研究结果给我们提供了我们如何可能实现这种解决方案的线索。关键在于PAM序列,它们决定着Cas9打开DNA双螺旋的位置和频率。不需多次打开DNA双螺旋的分子剪刀不仅更加快速地发现它们的靶序列,而且也会降低副作用产生的风险。”

癌症研究的最大挑战之一就是开发出适用于新疗法研究的临床前实验模型。事实上,目前很多在细胞或动物模型上体现出治疗潜力的药物或疗法在临床试验中往往效果不佳。
由于临床试验花费巨大,研究者们需要利用临床前模型对人类的疾病机制进行准确的探索与反应,从而最大化地确保药物对人类患者有相同的治疗效果。在最近发表在《Cell Stem Cell》杂志上的一篇文章中,来自MIT Broad研究所的博士后Zuzana Tothova等人开发出了弥补这一缺陷的方法。
利用CRISPR-Cas9技术对人源胚胎干细胞进行编辑,进而将其移植进入小鼠内,能够得到任意类型的研究白血病的小鼠模型。通过一系列的试验,作者发现该模型能够准确反映人体对抗癌药物的反映情况。
首先,作者通过分析大规模测序数据,找到了骨髓增生异常综合征(MDS)以及急性髓系白血病(AML)患者的常见突变类型,最终找到了9个常见于上述两类癌症类型的突变基因。
目前很多癌症模型都不能准确反映真实的癌细胞遗传学性状。而通过将人源的肿瘤细胞导入小鼠体内构建前临床模型又存在较大的技术难度。因此,为了研究MDS特异性突变以及其导致的癌症发生的机制,研究者构建了新型的小鼠模型。
Tothova等人根据此前分析得到了特定突变基因信息,利用CRISPR-Cas9技术对人员造血干细胞进行了靶向突变,进而使其具备了癌化潜力。之后,研究者们将这些改造后的细胞导入小鼠的血液系统,并且在5个月之后进行细胞提取测序以及观察细胞癌化的进展。
临床上常用于治疗MDS的去甲基化药物为azacitidine与decitabine。基于此前的研究结果,研究者们预测了这些药物在新构建的前临床小鼠癌症模型中的治疗效果。结果显示,azacitidine在小鼠模型中的治疗效果与其在人体水平的治疗效果相当。例如,TET2突变的细胞能够对上述药物产生反应,而ASXL-1突变细胞则对上述疗法存在耐受性。此外,研究者们还发现SMC3基因的突变会提高癌细胞对azacitidine的敏感性。这些结果表明新型的癌症前临床小鼠模型对于指导癌症疗法的开发具有重要的意义。
doi.org/10.1016/j.cell.2017.04.032

从它们硕大的果实以及紧密的枝干来看,西红柿的确是几千年人为培育的成果。然而,许多单独看来很有生产价值的性状背后的基因突变结合在一起反而会产生不如人意的结果。
来自冷泉港的遗传学家Zachary Lippman与同事们在鉴定出了这些有意思的基因突变之后,希望利用CRISPR基因编辑技术对西红柿进行改造,以提高其适应环境的能力以及产量。
“这听上去很诱人”,来自亚利桑那大学的植物遗传学家Rod Wing说道:”这一技术不仅仅可以用于改造西红柿,还能够用于所有作物的改良”。
腐烂的西红柿
Lippman从小对西红柿田地十分熟悉,在青少年时期,他就经常徒手摘西红柿,但他却不喜欢这个农活。”腐烂的西红柿发出的气味能够持续一整天。因此我总是盼望摘西红柿那天天会下雨”。
然而多年以后,他对于控制植物性状背后的遗传学原理的兴趣却使得自己重新回到了西红柿田中,试图寻找播种者们无意中引发的遗传变异。
1950年,研究者们在加拉帕戈斯群岛上发现了一种类似于西红柿的野生植物,该植物并没有肿胀的,被称为”节”的茎部。
节是植物的茎中最脆弱的部分,果实也因此容易掉落在地上。野生的植物依靠这一手段进行种子的传播,但对于采摘果实的农民来说可就变成了难题。因此,当时培育者们就将这一植物的性状整合入了当时的西红柿品种中,成为了无关节的西红柿。
这一新的性状随后带来了问题:当整合进入现有的西红柿品种中后,植物的开花枝长出了很多小的分支,就像一个扫帚一样。这些花消耗了植物太多的养分,导致果实产量的下降。为了解决这一问题,培育者们试图寻找其它遗传变异的植株并用于改变这一缺点。几十年后,Lippman研究组则成功地发现了该现象背后的遗传学机制。
1+1<1?
他们此前筛选了4193中不同的西红柿品种,试图找到与分支有关的类型。在这一筛选中,他们找到了两类基因。这两种基因合起来导致了分枝的过度形成,其中一个就负责关节的退化。相关结果发表在最近一期的《Cell》杂志上。
另外一个基因则是负责果实上方伞盖状叶子的形成。该性状的具体作用目前并不清楚,但研究者们认为可能与果实的增重有关。
在找到了这些基因之后,研究者们利用CRISPR基因编辑技术抑制了它们的功能。除了这两个基因之外,另外一个负责开花数量的基因也接受了改造。在众多的改造的排列组合中,作者发现其中有一部分品种的产量得到了增加。
这些发现能够帮助植物培育者们充分考虑雨中之后可能出现的负面效应,从而更加合理地设计育种方案。如今,他们正在与培育者们合作利用基因编辑技术改良西红柿的分支、花的数量以及果实的大小。”我们十分希望能够将基础科学知识应用于农业”。Lippman博士说道。
近年来,基因编辑技术正迅速影响着植物基因组学研究领域,在农作物育种、生态能源、工业原料、中药材等方面的应用前景也逐渐受到学术界及全社会的广泛关注。去年,美国的农业部率先敞开口子,对一批基因编辑农作物免于监管,我国政府也已经批准了几种用更早的基因工程技术培育的作物。比起治疗绝症,更优质的农产品可能会是基因组编辑带给普通人的第一项福利。
与其他物种不同的是,在植物中脱靶效应不是基因编辑技术的主要制约因素。目前,来自世界各地的研究者们已经在不同植物特别是农作物中建立起了基因编辑技术体系。如何进一步完善植物基因编辑技术,提高载体系统构建的简易性,提高特异性,降低脱靶率等将是未来植物基因组编辑领域的重要课题。(生物谷 Bioon.com)
相关新闻阅读:
2017年7月份4篇Nature、1篇Science、1篇Blood、2篇Cell及其子刊关注CRISPR/Cas重大突破
 基因君官网
基因君官网