今天,《自然医学》杂志上刊登了上海交通大学瑞金医院和华大基因共同完成的一项研究[1]!研究人员以中国的汉族年轻人为研究对象,确定了一个能抑制肥胖的肠道微生物——多形拟杆菌,还研究了其对代谢产物氨基酸水平的影响。研究的通讯作者为瑞金医院的宁光院士、王卫庆教授和华大基因的Karsten Kristiansen教授。

宁光院士(左)、王卫庆教授(中)和 Karsten Kristiansen教授(右)
新的研究让大家感到非常激动,为什么呢?因为我们知道,肠道微生物的组成和变化会受到许多因素的影响,比如年龄和饮食,然而还有一个平时可能被大家所忽略的因素就是种族[2]!因此,这项以中国汉族年轻人为样本的研究,对我国肠道微生物与肥胖研究领域来说有着十分重要的意义。
肠道微生物与肥胖之间存在着千丝万缕的联系
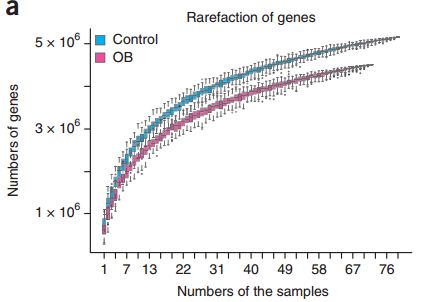
肥胖志愿者(粉色)与苗条志愿者(蓝色)的基因数量对比
测序结果显示,与过去在欧洲人群中开展的类似研究[3,4]相同,肥胖志愿者的肠道微生物多样性和基因数量都相对较低。但是,与研究中丹麦人群和法国人群不同,我们的志愿者的细菌基因丰度只有一个最大值,呈现出绝对优势,而丹麦人群与法国人群均有两个最大值,这也说明,不同的种族人群间,肠道微生物是存在一定差异的。
通过分析,研究人员找到了350524个与肥胖相关的基因,鉴定出它们所对应的微生物。研究人员发现,肥胖人群和苗条人群的肠道微生物确实存在巨大差异。
而且研究发现,之所以肥胖志愿者的拟杆菌属细菌大量减少,是因为代谢产物芳香族氨基酸(AAA)以及支链氨基酸(BCAA)的增加。这两类氨基酸在过去的研究中已经被证明与II型糖尿病[7]的发生发展有关。
在这次研究中,研究人员共分析了148种氨基酸,发现肥胖人群中谷氨酸的含量非常高,与苗条人群的差异也最大,而且在肥胖人群中,它的含量与多形拟杆菌的数量呈反比。
多形拟杆菌
于是研究人员进行了小鼠实验,希望用它们来直接证明多形拟杆菌与肥胖的关系。他们给正常饮食的小鼠移植了多形拟杆菌,发现小鼠的总脂肪量减少、肌肉量增加;类似的现象也发生在高脂饮食的小鼠中,它们体重增长的速度减慢,肥胖的倾向也不那么明显了。
而且有趣的是,与移植了灭活的多形拟杆菌和磷酸缓冲液(空白对照)的小鼠相比,活性拟杆菌组小鼠脂肪细胞体积明显减小!这与过去科学家发现的“肥胖者之所以胖,一部分是因为他们体内的脂肪细胞‘胖’(另外脂肪细胞的数量也会有一定影响)”的结论是一致的[8]。当然,这些小鼠体内参与脂肪合成、炎症因子产生的基因的表达量也都明显下降。
磷酸缓冲液(PBS)、灭活的多形拟杆菌(KBT)和保有活性的多形拟杆菌(LBT)脂肪细胞大小的对比
最后,研究还是回归到人的身上。研究人员又找到了23名接受过袖状胃切除术(sleeve gastrectomy)的志愿者,袖状胃切除术是代谢手术中的一种,通过腹腔镜把胃大弯切除,减小胃的体积,主要用于治疗肥胖和II型糖尿病。研究人员收集了他们在刚刚接受完手术、术后1个月和3个月的粪便样本,对肠道微生物以及代谢物等等的变化进行了分析。
袖状胃切除术
这个以我国汉族年轻人为样本的“本土化”研究其实也是“精准医学”的一个缩影,不同的遗传背景和环境以及饮食习惯塑造了不同的肠道菌群。所以基于这个研究,未来,科学家们会不会开发出针对中国肥胖人群的肠道微生物制剂呢?甚至可能这一思路对其他疾病的研究也会产生影响,改变许多疾病的治疗。忍不住要感叹一句,肠道微生物果然是“一座神秘的宝矿”啊!
[1] Ruixin Liu, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nature Medicine (2017) doi:10.1038/nm.4358.
[2] Mueller, S. et al. Differences in fecal microbiota in different European study populations in relation to age, gender and country: a cross-sectional study. appl. Environ. Microbiol. 72, 1027–1033 (2006).
[3] Le Chatelier, E. et al. Richness of human gut microbiome correlates with metabolic markers. Nature 500, 541–546 (2013)
[4] Cotillard, A. et al. Dietary intervention impact on gut microbial gene richness. Nature 500, 585–588 (2013)
[5] Qin, J. et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 490, 55–60 (2012).
[6] Peterson, C.T., Sharma, V., Elmén, L. & Peterson, S.N. Immune homeostasis, dysbiosis and therapeutic modulation of the gut microbiota. Clin. Exp. Immunol. 179, 363–377 (2015).
[7] Wang, T.J. et al. Metabolite profiles and the risk of developing diabetes. Nat. Med. 17, 448–453 (2011).
[8] Hirsch, J. and B. Batchelor, Adipose tissue cellularity in human obesity. Clin Endocrinol Metab, 1976. 5(2): p. 299-311.
[9] Bunyan, J., Murrell, E.A. & Shah, P.P. The induction of obesity in rodents by means of monosodium glutamate. Br. J. Nutr. 35, 25–39 (1976).
 基因君官网
基因君官网
