2018年6月2日/生物谷BIOON/—随着科学家们深入了解哪些基因可以促进疾病产生,他们正在追求解答下一个合乎逻辑的问题:能够开发出基因编辑技术来治疗甚至治愈这些疾病吗?大部分研究工作都集中在开发诸如CRISPR/Cas9(一种基于蛋白的基因编辑系统)之类的技术。
在一项新的研究中,美国斯克里普斯研究所化学系的Matthew D. Disney博士及其团队采取了一种不同的方法,开发出一种基于小分子的工具,这种方法作用于RNA上,从而选择性地剔除某些基因产物。这就进一步证实RNA确实是开发药物的一种可行的靶标。
Disney团队开发出的这种剔除工具为开发作为药丸加以服用来校正遗传疾病—通过破坏有毒的基因产物和化学控制身体的防御机制—的药物提供了可能。相关研究结果于2018年5月24日在线发表在Journal of the American Chemical Society期刊上,论文标题为“Small Molecule Targeted Recruitment of a Nuclease to RNA”。
RNA是细胞内存在的一组不同的分子,它们读取、调节和表达DNA的遗传指令。在我们的细胞内,RNA始终在运动中。它们聚集在一起,履行职责,然后被RNA降解酶降解进行循环利用。RNA降解酶是切割RNA分子的化学剪刀。
Disney说,尽管大约2%的人类基因组编码蛋白,但是70%到80%的人类基因组经转录后产生RNA,这就潜在地提供更多的药物靶标。然而,直到最近,大多数人认为RNA是无药可靶向的(undruggable),这是因为它们具有较小的尺寸且相对地缺乏稳定性。
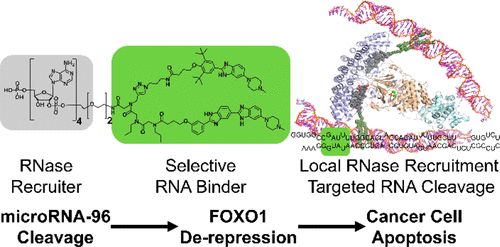
Disney的创新之处在于将一种类似药物的小分子—一种经设计后能够精确和有选择性地结合特定RNA的分子—与一种常见的RNA降解酶结合在一起。设计出的这种小分子/酶复合物结合到不需要的基因产物上并将它摧毁。Disney将这种技术命名为RIBOTAC,即“核糖核酸酶靶向嵌合体(ribonuclease-targeting chimeras)”的缩写。
为了测试RIBOTAC技术,Disney选择了RNA降解酶RNase L,它是人类抗病毒免疫反应的一个关键部分。RNase L在每个细胞中都有少量存在,通常在遭受病毒感染时,它就大量产生来破坏病毒RNA并战胜疾病。
针对RIBOTAC复合物的另一个部分,即药物类似分子,Disney选择了Targaprimir-96,这是他的实验室在2016年设计的一种分子,用于与一种已知促进癌细胞增殖(特别是在很难治疗的三阴性乳腺癌中)的microRNA致癌基因(即miRNA-96)结合。
论文第一作者、Disney实验室研究生Matthew G. Costales说,通过增加FOXO1基因表达破坏miRNA-96会导致癌细胞固有的自毁程重新激活,最终促使这些恶性肿瘤细胞死亡。
Costales说,“将我们之前针对Targaprimir-96的研究与靶向招募RNase L结合在一起,我们能够对这种RIBOTAC方法进行编程以便仅降解高度表达miRNA-96致癌基因的细胞,因而允许FOXO1发出选择性破坏三阴性乳腺癌细胞的信号。”
Disney说,激活人体利用细胞的RNA降解系统杀死自身癌症的能力提供了一种新的方法来攻击癌症。他说,这种RIBOTAC技术也可能广泛应用于癌症和其他的由基因触发的疾病。
Disney实验室花费了多年时间开发出一种被称作Inforna的计算方法,将具有足够稳定性和特定结构的RNA与能够结合它们的药物类似小分子匹配在一起。这种技术导致了Disney团队开发出Targaprimir-96和多种其他的疾病修饰性化合物,其中一些化合物如今正迈向临床开发。(生物谷 Bioon.com)
参考资料:
Matthew G. Costales†, Yasumasa Matsumoto†, Sai Pradeep Velagapudi et al. Small Molecule Targeted Recruitment of a Nuclease to RNA. Journal of the American Chemical Society, Published online:May 24, 2018, doi:10.1021/jacs.8b01233
 基因君官网
基因君官网