2018年10月5日/生物谷BIOON/—多能性的胚胎干细胞形成所有组织类型的分化潜力是由金标准的畸胎瘤(teratoma)形成方法确定的。畸胎瘤是一种良性肿瘤,由三个胚层(外胚层,中胚层和内胚层)和未加以组装的组织混合物组成。迄今为止,人们尚不清楚在细胞介导的再生医学中源自畸胎瘤的成纤维细胞(teratoma-derived fibroblast, TDF)是否可作为骨再生的干细胞来源。
在一项新的研究中,来自韩国高丽大学的研究人员从将人胚胎干细胞植入到免疫缺陷的小鼠体内产生的畸胎瘤中分离出成纤维细胞(即TDF)。这些分离出的TDF细胞能够分化为成骨细胞(osteoblast)。他们将编码骨形态发生蛋白2(BMP2)—一种有效的促进骨形成的生长因子—和单纯疱疹病毒胸苷激酶(HSV-tk)的基因导入到TDF细胞中,从而产生一种特定的功能性TDF细胞系(TDF BMP2/HSV-tk),这种细胞系在体内诱导骨再生。通过设计,在骨再生启动后,一旦接受更昔洛韦(GCV, 一种抗病毒药物)处理,这些TDF细胞由于存在HSV-tk/GCV基因标志物而发生凋亡,从而被清除掉。这提示着这个HSV-tk自杀基因可能调节干细胞疗法的副作用,包括不受控制的畸胎瘤和肿瘤形成。相关研究结果于2018年10月1日发表在Scientific Reports期刊上,论文标题为“Engineering functional BMP-2 expressing teratoma-derived fibroblasts for enhancing osteogenesis”。
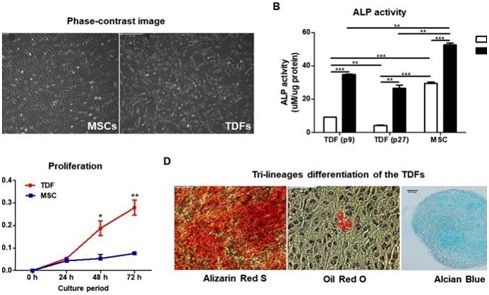
之前的研究已报道了重新注射TDF细胞并不会在患有严重联合免疫缺陷(severe combined immunodeficiency, SCID)的小鼠中重新形成畸胎瘤,这就解决了在体内促进骨再生后TDF细胞群体中出现癌细胞样特征的问题。在这项新的研究中,这种功能性TDF细胞系在体外表现出增强的碱性磷酸酶(ALP)活性,增加的钙含量和成骨基因的mRNA上调表达,随后在体内动物模型中显著改善骨体积形成。这项研究揭示了一种安全的高效的用于骨再生治疗应用的技术。(生物谷 Bioon.com)
参考资料:
Yoon Young Go, Ji Yeon Mun, Sung-Won Chae et al. Engineering functional BMP-2 expressing teratoma-derived fibroblasts for enhancing osteogenesis. Scientific Reports, Published Online: 01 October 2018, doi:10.1038/s41598-018-32946-6.
 基因君官网
基因君官网