2018年12月8日/生物谷BIOON/—心血管疾病是心脏病、中风和其他的影响心脏和血管的疾病的总称。根据世界卫生组织(WHO)的数据,心血管疾病是世界上死亡的主要原因,每年导致全球大约1800万人死亡。这类疾病通常源于动脉粥样硬化,即血管内的斑块堆积,这能够阻断血液流动并引起血管壁破裂。
许多因素让人们具有更高的心血管疾病风险,包括高胆固醇、高血压、吸烟、肥胖和不活动。近年来,基因组研究已揭示了心血管疾病的一些主要的遗传风险。9p21.3单倍型(9p21.3 haplotype)是与冠状动脉疾病—一种让将血液输送到心脏中的血管受到破坏的疾病—风险增加相关的第一个常见的基因组区域,而且它还会增加动脉瘤和中风等相关疾病的发病几率。它是目前世界上已知最具影响力的心血管疾病遗传原因。在美国,它每年导致10%~15%的心血管疾病病例。
尽管科学家们知道9p21.3单倍型与疾病风险增加有关,但是这是如何在人体中发生的仍然是个未知数。一个挑战在于这种疾病风险单倍型仅在人类中发现,与小鼠或其他实验动物中的基因组区域存在着较差的相似性。另一个挑战在于这个称为9p21.3单倍型的基因组区域缺乏任何传统意义上的蛋白编码基因,因此很难预测它可能发挥着什么作用。
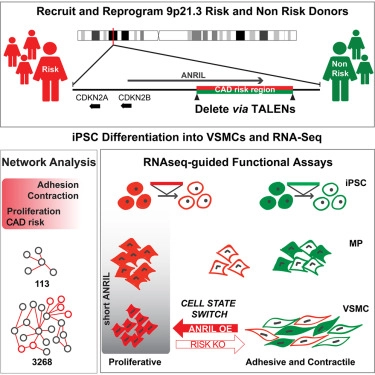
为了克服这些研究挑战,在一项新的研究中,美国斯克利普斯研究所的Kristin Baldwin教授及其团队想要在培养皿中产生人血管细胞,随后利用基因组编辑对它们进行遗传研究。他们收集了来自携带着9p21.3单倍型高风险版本或低风险版本的人的血液,并让血液中的细胞经过重编程后产生诱导性多能干细胞(iPS细胞)。在这个阶段,利用称为转录激活因子样效应物核酸酶(TALEN)的分子剪刀对产生的iPS细胞进行基因修饰,从而移除来自受到影响的供者细胞和未受到影响的供者细胞的9p21.3单倍型风险促进版本或良性版本。接下来,他们诱导这些经过基因编辑的ips细胞变成血管平滑肌细胞,并利用高分辨率基因谱和生物工程方法详细地研究它们。相关研究结果于2018年12月6日在线发表在Cell期刊上,论文标题为“Unveiling the Role of the Most Impactful Cardiovascular Risk Locus through Haplotype Editing”。
Baldwin团队发现源自高风险个体的血管平滑肌细胞表现出极其广泛的异常,而且在这些携带着9p21.3单倍型高风险版本的血管平滑肌细胞(下称高风险血管平滑肌细胞)中,3000多个基因受到影响—将近占人类基因总数的10%。对这些基因进行的基于计算机的研究结果表明这些高风险血管平滑肌细胞可能在与疾病相关的关键功能方面存在缺陷。当在实验室进行测试时,Baldwin团队发现,与携带着9p21.3单倍型低风险版本的血管平滑肌细胞(下称低风险血管平滑肌细胞)相比,成熟的高风险血管平滑肌细胞更加脆弱,收缩力更小和更不能够地粘附于它们的周围环境。
接下来,Baldwin团队想要知道这3000个左右的基因是否可能有助于揭开最近发现的与冠状动脉疾病风险相关的大约100个其他基因的影响。出乎意料的是,这些高风险血管平滑肌细胞在三分之一以上的基因(38个基因)上发生变化,这表明9p21.3单倍型以某种方式与这种基因网络相互作用或甚至控制这种基因网络。
通过更深入地研究,Baldwin团队鉴定出一个潜在的关键主调节因子(ANRIL),它本身是一类神秘的基因的一个成员,不会产生蛋白,但会产生长链非编码RNA(lncRNA)分子。他们注意到高风险血管平滑肌细胞具有更高水平的几种较短的ANRIL RNA形式。当他们将这些较短的ANRIL RNA添加到健康的血管平滑肌细胞中时,它们出现了疾病的关键特征,这表明这些较短的ANRIL RNA可能是血管平滑肌细胞在健康状态和疾病促进状态之间进行转换的主导体蛋白(master conductor)。此外,利用基因组编辑剔除高风险血管平滑肌细胞中的9p21.3单倍型高风险版本会拯救它们的稳定性。
这项研究展示了对多能性干细胞进行基因组编辑来研究人类疾病的遗传风险的力量,特别是遗传风险在人类基因组区域或者垃圾DNA中是独特的。这些研究结果不仅提供了关于这种9p21.3单倍型高风险版本如何破坏血管健康的新见解,而且也提供了一条新途径来研究和靶向广泛参与冠状动脉疾病的基因调控网络。
值得注意的是,9p21.3单倍型对血管平滑肌细胞的功能特征和遗传特征产生如此重大的影响。 虽然它不能编码蛋白,但是它对疾病的影响是重大的。鉴于这项研究揭示出它在破坏血管壁中发挥的作用,人们有可能开发出一种更好的方法来阻止它。(生物谷 Bioon.com)
参考资料:
Valentina Lo Sardo et al. Unveiling the Role of the Most Impactful Cardiovascular Risk Locus through Haplotype Editing. Cell, Published online: December 6, 2018, doi:10.1016/j.cell.2018.11.014.
 基因君官网
基因君官网