2019年1月25日/基因宝jiyinbao.com/—基因驱动(gene drive)是一种基因工程技术,它促进后代要比正常情形时更频繁地遗传来自一个亲本的特定等位基因。它已在昆虫中发挥作用。如今,在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员发现它也能够成功地在脊椎动物中发挥作用。在这项研究中,他们描述了一种方法,它利用CRISPR-Cas9改变雌性小鼠生殖系细胞,从而促进小鼠后代出现白色毛发和表达一种红色荧光蛋白。相关研究结果于2019年1月23日在线发表在Nature期刊上,论文标题为“Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline”。
英国爱丁堡大学研究员Bruce Whitelaw(没有参与这项研究)说,“这是第一篇强有力地描述基因驱动在哺乳动物中发挥作用的论文。”
根据论文通讯作者、加州大学圣地亚哥分校进化发育生物学家Kimberly Cooper的说法,启动这个研究项目的原因在于她和她的团队想要能够复制其他物种的遗传变化,这样他们就能够理解这些变化如何导致特定性状。但是,利用传统的小鼠遗传学,将多个转基因组合在一起并且让小鼠中每个转基因的两个等位基因保持纯合是很棘手的。比如,在两只小鼠中,让每只小鼠携带相同的三个基因的突变拷贝需要将近150个后代才有90%的机会让它们中的一个后代是纯合的三重突变体。
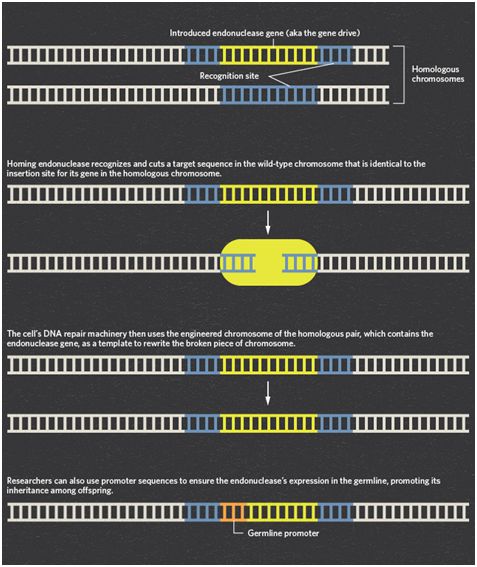
Cooper及其团队寻求加州大学圣地亚哥分校的Ethan Bier和Valentino Gantz的帮助,其中Bier和Gantz在2015年描述了在果蝇中成功使用了基因驱动(Science, doi:10.1126/science.aaa5945)。
他们特别强调了这种技术能够将杂合突变快速转化为果蝇群体中的纯合突变。目标是在特定的染色体位置上用Cas9切割DNA。随后,通过一种称为同源介导修复(homology directed repair)的过程校正这种DNA断裂,在这种过程中,同源染色体上的互补基因座用作模板。就2015年的这种果蝇基因驱动而言,这种模板携带着的向导RNA(gRNA)靶向一个将被编辑的野生型基因和cas9基因。通过这种方式,存在于一条染色体上的这个经过编辑的基因最终在另一条染色体上复制,从而增加了它在下一代中遗传的可能性。
Cooper说,尽管基因驱动在果蝇中取得了成功给人们带来了希望,但是“它在小鼠中的效果并不明显,这是因为昆虫和小鼠在7.5亿多年前就与共同的祖先分歧开来”,在那么长的时间里,“很多东西都可改变这种机制在动物身上的作用。”
在这项新的研究中,Cooper团队着重关注编码酪氨酸酶(Tyrosinase)的基因,它决定着毛发颜色,并且让这些研究人员容易观察他们的这个经过编辑的基因是否发生了复制。他们将含有gRNA的基因驱动插入到Tyrosinase基因的第四个外显子中,其中这种gRNA能够将Cas9引导到Tyrosinase基因和一个编码红色荧光蛋白的基因上。
在将精子、卵子和胚胎发育过程中的不同时间和不同地方将一个激活cas9的转基因引入到小鼠群体中后,Cooper团队观察了他们培育出的小鼠是否具有白色的毛发,这是因为这可表明Cas9是否切割了Tyrosinase基因,此外,他们还观察它们是否发出红光荧光,这是因为这意味着遭受切割的Tyrosinase基因是否已被经过编辑的基因拷贝修复。
Cooper团队发现当在雌性小鼠卵子发育期间激活Cas9时,这个经过编辑的基因以高于50%(最好时大约72%)的频率进行复制。在早期的胚胎发育期间或者在雄性精子发育期间激活Cas9不会导致同源介导修复,相反地,这会主要导致Cas9靶位点发生插入或缺失。
这些研究人员正在优化Cas9在雌性小鼠中产生的时间,并且正在研究更高的效率是否可能解决雄性动物中同源介导修复的缺乏。Cooper说,“这是首个证据表明基因驱动可在哺乳动物中发挥效果,但是它并不完美,因此我们想要让它变得更好。”(生物谷 Bioon.com)
参考资料:
H.A. Grunwald et al., “Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline,” Nature, doi:10.1038/s41586-019-0875-2, 2019.
 基因君官网
基因君官网