2019年2月14日讯/生物谷BIOON/—CRISPR是一种通过高精度基因组编辑引发生物医学研究变革的技术。然而,即使它允许相对容易地产生或校正由单个或几个核苷酸组成的突变,在对基因组中较大DNA片段进行编辑时,它仍然存在着限制。比如,将产生荧光蛋白(比如广泛使用的绿色荧光蛋白)的基因插入到基因组中具有较低的效率,而且涉及复杂的克隆步骤。
在一项新的研究中,西班牙Bellvitge生物医学研究所(IDIBELL)的Julián Cerón博士及其团队使用秀丽隐杆线虫来优化这种技术,从而开发出一种称为嵌套CRISPR(nested CRISPR)的方法。这种非克隆方法涉及分两步插入长DNA片段。在第一步中,将这个长片段DNA的一小部分(小于200个碱基)插入到基因组中。在第二步中,这一小部分DNA片段随后起着“巢穴”或“着陆垫(landing pad)”的作用,用于高效地插入较长的DNA片段(大约1000个碱基)。相关研究结果于2019年1月31日在线发表在Genetics期刊上,论文标题为“Efficient Generation of Endogenous Fluorescent Reporters by Nested CRISPR in Caenorhabditis elegans”。
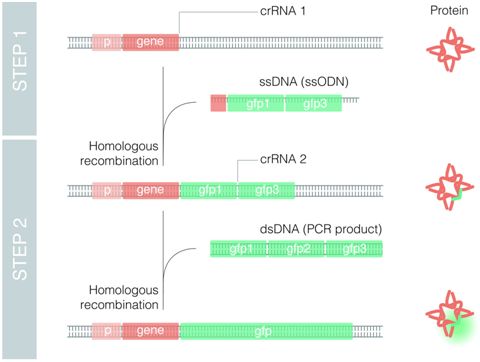
这项研究引起了前所未有的兴趣。具有短生命周期的模式生物(比如秀丽隐杆线虫)使得科学家们能够探究CRISPR的可能性和局限性。论文第一作者Jeremy Vicencio与博士后研究员Carmen Martínez和Xènia Serrat一起,在秀丽隐杆线虫生殖细胞中进行了数百次显微注射并开展了上千次基因分型,从而可靠地和令人信服地证实了嵌套CRISPR的效率。
嵌套CRISPR利用商业上的寡核苷酸进行第一步的DNA修复,并利用通用PCR产物进行第二步。这使得用荧光蛋白标记数百个基因成为可能,从而有利于开展大规模实验。此外,鉴于嵌套CRISPR是模块化的,因此人们也可将其他感兴趣的目标肽或蛋白与这些荧光蛋白一起进行整合。比如,Cerón团队目前正致力于利用以一种可控方式遭受降解的肽对这些荧光蛋白进行标记。
最后,Cerón团队打算利用嵌套CRISPR将秀丽隐杆线虫中的基因用人体中的同源基因加以替代。这将促使使用这种小型的线虫作为一种多细胞模型来研究与疾病相关的人体基因突变的影响。这一系统在个性化医疗领域具有重要意义,这是因为它能够快速有效地提供关于一种基因突变或基因组变异(称为多态性)的致病性的预后。(生物谷 Bioon.com)
参考资料:
Jeremy Vicencio et al. Efficient Generation of Endogenous Fluorescent Reporters by Nested CRISPR in Caenorhabditis elegans. Genetics, 2019, doi:10.1534/genetics.119.301965.
 基因君官网
基因君官网