前言
医药人都知道药品研发周期长、成本高、成功率低,因而如何提高研发速度、降低研发风险、优化生产工艺便是医药企业的重大议题。近年来随着医药专业外包行业的兴起,CRO(Contract Research Organization,合同研究组织)、CRA(Contract Regulatory Affairs Organization,合同注册组织)与医药研发生产企业的紧密合作已经成功地将多种化学药、生物药推向了市场,那么CRO/CRA的升级版–CDMO(Contract Development Manufacture Organization,合同研发生产组织)在医药领域,特别是细胞与基因治疗领域的应用如何呢?本文将重点评述。
CDMO
相信广大生物医药领域的专业人士对CRO早已熟悉,但CDMO看似还是个新鲜事物。在外包合作形式的推动下,生物医药工业外包合作形式由初级的CRO/CRA进一步扩展到了CDMO/CMO。CDMO模式将从临床前研究、临床试验到大规模生产阶段与企业的研发、采购、生产等整个供应链体系深度对接,为企业提供创新性的工艺研发及规模化生产服务,同时以技术输出取代单纯的产能输出。
CDMO企业的组织模式
不同与其他领域,药品的研发与生产面对的是最严苛的审查,同样,CDMO企业所涉及的研发技术、环境设备、生产工艺等因素都具有严格的标准和准入门槛,不过正是这些严苛的标准,确保了CDMO企业能够在项目管理、生产、过程优化、安全环保等方面接受客户及药品监督管理机构的监督与审查。因此,CDMO模式能够优化创新药开发工艺、显著降低生产成本、控制研发及生产风险,对创新药物的研发和上市具有推助作用。
CDMO在基因/细胞治疗领域的应用
在各种适应症需求的推动下,细胞与基因治疗快速发展,多种CAR-T疗法、干细胞疗法、基于腺相关病毒及慢病毒的基因疗法相继问世,为复发难治性肿瘤及严重的基因遗传缺陷类疾病提供了重要的治疗选择。那么在化药和生物药领域行之有效的CDMO模式是否在细胞与基因治疗领域同样适用呢?答案是肯定的,以CELL for CURE公司为例,该公司于2013年在法国成立,是欧洲地区最早也是规模最大的CDMO公司,专注于细胞与基因治疗药物的生产。早在2014年,CELL for CURE便与CELLECTIS签署了合作伙伴关系,用于生产同种异体CAR-T细胞产品,诺华公司于2018年12月正式宣布收购CELL for CURE公司。
由此可见,不仅仅是初创公司,那些世界级的重磅医药公司也纷纷布局CDMO。特别是对于CAR-T疗法及干细胞疗法,其具有不同于传统化药和生物药的诸多特点:1. 以细胞为基础,细胞的质量及数量对治疗起决定性作用;2. 细胞在增殖过程中,可能发生基因及核型不稳定的情况;3. 细胞在转运过程中,易受多种因素(温度、二氧化碳浓度、湿度)的影响。因此在基因/细胞治疗领域,具备成熟的技术的专业CDMO公司对基因/细胞疗法的研发与生产具有重要推动作用。
CDMO在基因/细胞治疗领域的前景
从市场需求来看,随着中国医药资本市场的壮大,国内越来越多的创新型公司,特别是专注于基因/细胞疗法的创新公司不断涌现,因此国内医药市场对CDMO的需求也会越来越大。同时随着药品上市许可人制度(MAH)的逐步推广,未来对CDMO的需求将会进一步得到释放。因此,CDMO模式方兴未艾,如药明康德在2018年深度布局体外精准医疗研发生产服务等业务领域,在细胞、基因治疗领域复制CDMO模式,为CAR-T,TCR,癌症免疫疗法、腺相关病毒(AAV)及慢病毒(Lenti-Virus)基因疗法提供生产平台。
总结
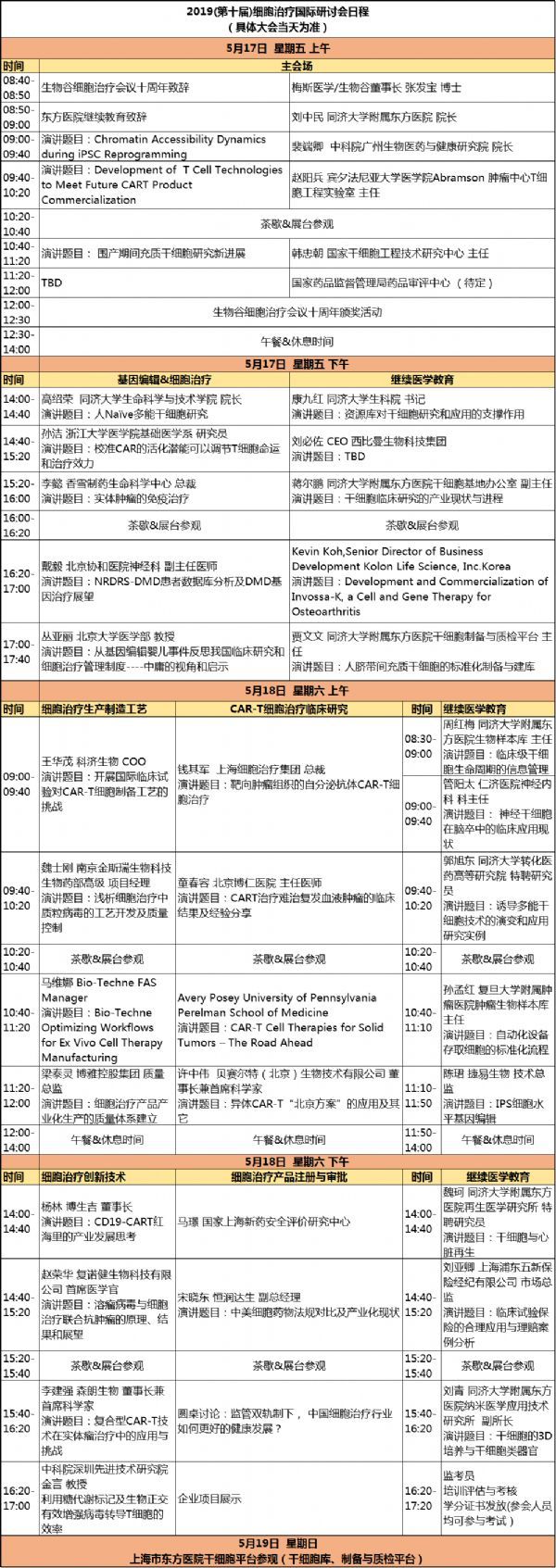
纵观CDMO/CMO在健康产业的商业模式,虽然国内起步较晚,但在发展速度同样令人惊叹。2018年6月11日,国家发改委联合工信部、国家卫健委、国家药监局发布关于《组织实施生物医药合同研发和生产服务平台建设专项》的通知,为推动优势企业建立健全服务体系,国家将采取补助资金的形式推动外包产业的发展,这一举措可视为我国在CDMO领域的又一里程碑。5月17-18日,生物谷将举办2019(第十届)细胞治疗国际研讨会,本次会议的主题是“加快中国细胞治疗产品的上市”,设置主会场、基因编辑与细胞治疗专场、CAR-T与干细胞临床研究专场、细胞治疗生产制造工艺专场和细胞治疗产品注册与临床申报专场。 会议将继续以转化医学为切入点,以基础研究与临床应用相结合,邀请国内外顶尖的细胞治疗基础研究和临床专家,瞄准细胞治疗研究的最新研究动态和进展, 围绕上市从细胞治疗的临床监管、治疗规范、细胞治疗安全性,新型细胞治疗技术、实体瘤治疗、肿瘤免疫检查点抑制剂、间充质干细胞临床应用、干细胞移植治疗、基因编辑与细胞治疗、细胞治疗生产制造工艺等热门议题进行讨论。
何老师
E-mail: chunxing.he@medsci.cn
Mt: 17321098232
 基因君官网
基因君官网