2019年5月18日讯/生物谷BIOON/—Wnt/β-连环蛋白信号转导是哺乳动物发育的关键调节因子。在造血系统中,Wnt/β-连环蛋白信号转导促进造血干细胞(HSC)的存活和更新以及定向分化为造血祖细胞和淋巴细胞。然而,Wnt/β-连环蛋白的表型效应是较为复杂的,这是因为过量或不足的β-连环蛋白活性具有有害后果。比如,导致Wnt/β-连环蛋白信号转导水平梯度的亚效或无效Apc等位基因的组合导致HSC在低活化水平下增殖或在高活化水平下HSC池枯竭。其他报道表明,Wnt/β-连环蛋白通路的活化能够促进淋巴细胞的凋亡并减少处于静止状态的HSC数量。
在一项新的研究中,在对影响淋巴细胞生成和免疫反应的突变进行小鼠正向遗传筛选中,来自美国德克萨斯大学西南医学中心的研究人员在Lmbr1l基因中鉴定出一种隐性的亚效突变(hypomorphic mutation),这种突变导致血液中的T细胞频率降低。对Lmbr11突变小鼠的进一步表型分析表明所有淋巴细胞谱系的发育严重受损,对疫苗接种的抗体反应受损,细胞毒性T淋巴细胞杀伤活性降低,自然杀伤(NK)细胞功能和对小鼠巨细胞病毒感染的抗性下降。缺乏LMBR1L的T细胞易发生凋亡并且在抗原特异性或稳态扩增信号存在下死亡。他们还发现HSC分化为淋巴预处理多能祖细胞(lymphoid-primed multipotent progenitor, LMPP)和产生T细胞、B细胞和NK细胞的常见淋巴祖细胞群体的能力受到破坏。他们还研究了Lmbr1在淋巴细胞发育中的分子功能。相关研究结果发表在2019年5月10日的Science期刊上,论文标题为“LMBR1L regulates lymphopoiesis through Wnt/β-catenin signaling”。
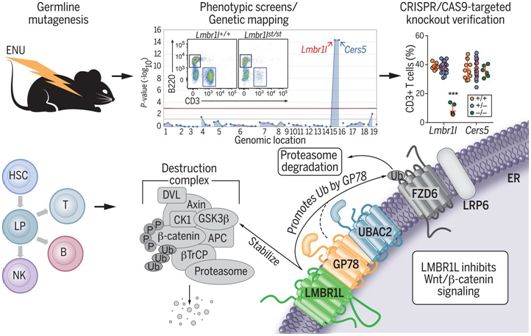
LMBR1L含有9个跨膜结构域,并且在细胞分级分离实验中,它在内质网(ER)部分中是最为丰富的。LMBR1L与Wnt/β-连环蛋白信号转导复合物中的多种成分(包括ZNRF3、LRP6、β-连环蛋白、GSK-3α和GSK-3β)免疫共沉淀,而且也与参与错误折叠蛋白的内质网相关性降解的蛋白–UBAC2、TERA、UBXD8和GP78—免疫共沉淀。
来自Lmbr1l−/−小鼠的原代CD8+ T细胞显示出β-连环蛋白和成熟形式的Wnt受体FZD6和辅助受体LRP6在表达水平上的增加。这些效应是由于LMBR1L-GP78-UBAC2复合物不能提供信号来让内质网中的β-连环蛋白、FZD6和LRP6发生降解。类似地,在Gp78−/−原代CD8+ T细胞中检测到β-连环蛋白和成熟FZD6和LRP6的表达增加。此外,在Lmbr1l−/−原代CD8+ T细胞中观察到 “破坏复合物(destruction complex)”的多种组分[Axin1、DVL2、β-TrCP、GSK-3α、GSK-3β和CK1]的蛋白表达下降。值得注意的是,Lmbr1l−/−EL4细胞(一种T淋巴瘤细胞系)中β-连环蛋白的敲除在很大程度上恢复了增殖潜能,并减少了由LMBR1L缺乏引起的细胞凋亡。
在LMBR1L缺乏的情形下,Wnt/β-连环蛋白信号转导遭受异常激活,从而导致小鼠中所有淋巴细胞谱系的发育受损和功能缺陷。也许是因为需要精确调节,Wnt/β-连环蛋白通路的一个突出组分是经典的破坏复合物,它确保在不存在Wnt配体的情况下β-连环蛋白在细胞质中受到破坏。这些研究结果揭示了这种制动系统的另一个组成部分:定位于内质网中的LMBR1L-GP78-UBAC2复合物,它负责淋巴细胞中FZD和LRP6的降解。尽管指导LMBR1L-GP78-UBAC2复合物活化的上游信号是未知的,但是这些研究人员猜测这种复合物与经典破坏复合物之间的界面让这些复合物的活性保持同步并且通过单一制动机制避免泄漏性抑制(leaky inhibition)。(生物谷 Bioon.com)
参考资料:
Jin Huk Choi et al. LMBR1L regulates lymphopoiesis through Wnt/β-catenin signaling. Science, 2019, doi:10.1126/science.aau0812.
 基因君官网
基因君官网