2019年6月13日讯 /生物谷BIOON /——基因正常表达是生物生长、发育等一切生命活动的基础之一,它在细胞分裂分化、组织器官形成和发育等过程中发挥着至关重要的角色,而异常的基因表达与多种疾病(如癌症等)密切相关。为此,本文中小编为大家盘点了关于基因表达在机体各方面功能和疾病中的新功能的最新研究进展,与大家一起学习进步!
尽管近几十年来我们对人体细胞和组织的了解逐步增加,但许多问题仍然没有得到揭示。例如,实验室中用于研究细胞类型的技术具有局限性,而且不能实现对细胞功能的精细细节。为克服这一障碍,由Holger Heyn领导的西班牙巴塞罗那基因组调控中心(CRG)的国家基因组分析中心(CNAG-CRG)的一组科学家开发了一种新的计算工具,基于数学理论,能够推断健康和病理器官的全球大规模调节网络。研究人员能够确定与器官功能和疾病潜在驱动因素相关的基因。
“我们以前开发的单细胞转录组学工具对于发现未知细胞类型非常有用,”作者说到: “这些工具使我们能够描述细胞的新类型和亚型,具有独特的生物学作用和等级关系”。到目前为止,已经使用单细胞分析来了解细胞类型及其在组织内的功能。而最近研究开发的工具将使他们更进一步,观察基因如何相互作用,最终促进组织的形成。 “我们的工具试图准确地解决控制细胞形态和功能的调节过程,”作者强调说。
CNAG-CRG研究人员处理了来自成千上万个细胞的数据集,以推断驱动细胞表型形成及其各自功能的调节网络。他们运用这一新型工具研究II型糖尿病和阿尔茨海默病,并且能够找到与这些疾病相关的功能变化。这为寻找新的药物目标打开了大门。
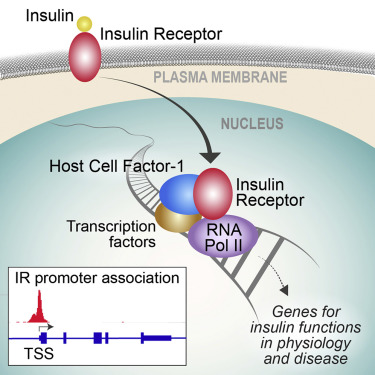
胰岛素受体(IR)信号传导是正常代谢控制的核心,并且在流行的慢性疾病中失调。胰岛素受体在细胞表面与胰岛素结合并通过细胞质激酶快速地传导信号。然而,调节胰岛素长期作用的机制尚不清楚。
图片来源:Cell
在一项新的研究中,来自美国麻省总医院、哈佛医学院和哈佛大学陈曾熙公共卫生学院的研究人员发现胰岛素受体与细胞核中的RNA聚合酶II结合,并且在全基因组范围内的启动子上显着富集。目标基因高度富集胰岛素相关功能,包括脂质代谢、蛋白合成以及包括糖尿病、神经变性和癌症在内的疾病。相关研究结果发表在2019年4月18日的Cell期刊上,论文标题为”Insulin Receptor Associates with Promoters Genome-wide and Regulates Gene Expression”。
胰岛素增加胰岛素受体在染色质上的结合,但是在一种胰岛素抗性疾病模型中,胰岛素受体在染色质上的结合受到破坏。胰岛素受体结合到启动子上由一种称为宿主细胞因子-1(HCF-1)的共调节因子和转录因子介导,这就揭示出胰岛素对基因调节的一种HCF-1依赖性途径。由此可见,这些结果表明胰岛素受体与启动子上的转录复合物(transcriptional machinery)相互作用,并鉴定出一种对与胰岛素在生理和疾病中的作用相关的基因进行调节的途径。
自噬(Autophagy)是一种重要的机体生物性循环机制,其能有效维持机体所有组织内部的自我平衡,很多研究都尝试理解机体自噬水平的降低与老化进展之间的关联,然而截止到目前为止研究人员并未给出一种清楚的解释。
近日,一项刊登在国际杂志Nature Communications上的研究报告中,研究人员通过研究发现,在线虫、果蝇和小鼠组织中,Rubicon的表达水平会以一种年龄相关的方式增加。
研究者Yoshimori说道,Rubicon被认为能够有效抑制自噬的过程,而敲除小鼠机体中的Rubicon就能够帮助减缓自噬相关肝脏疾病的发生,因此,研究者推测,Rubicon或许会通过其与机体自噬过程的相互作用来直接影响机体衰老。这项研究中,研究者发现,多个衰老动物模型(线虫、果蝇和小鼠)机体组织中Rubicon的水平会增加,当抑制Rubicon的表达后,所有模式动物都会表现出机体自噬活性的增加,从而就会明显改善多个年龄相关的因子,并能适当延长线虫和果蝇的寿命。
研究者指出,模式动物机体中Rubicon的表达会导致其与年龄相关的运动能力发生下降,同时其机体纤维化的水平也会发生下降;更重要的是,研究者还发现,Rubicon的表达会使得衰老的小鼠抵御诱发帕金森疾病的倾向。由于Rubicon水平的增加会导致老化动物机体中自噬水平下降,因此抑制Rubicon的表达或许有望延长人类的健康寿命。
近日,一项刊登在国际杂志Circulation上的研究报告中,来自西班牙国家心血管病研究中心的科学家们通过研究发现,血细胞中CD69分子的表达水平或能帮助预测个体的动脉粥样硬化风险。
研究者指出,CD69或能作为一种T细胞受体来氧化脂蛋白从而促进炎症控制并抑制动脉粥样硬化的发生,将LDLox与CD69相结合就能诱发T淋巴细胞采取抗炎性措施,保护小鼠和人类机体中动脉粥样硬化的发生。文章中,研究者利用缺失CD69基因的小鼠进行研究,同时通过对来自305名参与者血液样本中淋巴细胞表达的CD69进行分析后,研究者证实了该研究结果的临床相关性。
本文研究结果表明,机体循环的淋巴细胞中CD69的表达与亚临床动脉粥样硬化的存在和疾病严重程度呈负相关关系。如今心血管疾病是诱发全球人群死亡的主要原因,因此后期研究人员还需要进行更为深入的研究来开发治疗动脉粥样硬化的新型疗法和策略。
近日,一项刊登在国际杂志EbioMedicine上的研究报告中,来自阿拉巴马大学的科学家们通过研究发现,线粒体或能改变机体的代谢和基因表达。研究者Scott Ballinger博士表示,在长达50年的时间里,科学家们一直在利用孟德尔遗传学来寻找机体的疾病易感性,线粒体DNA对疾病易感性的可能性影响取决于两个事实,首先一个人机体所有的线粒体DNA都来自于母亲(卵细胞),这与细胞核中染色体的基因并不相同(一半来自母亲,一半来自父亲),其次,人类线粒体DNA会进化成为不同的单体型,每一种类型都会遗传特殊的线粒体DNA突变,目前大约有25-35种基本的线粒体DNA单体型。
图片来源:http://cn.bing.com
为了调查线粒体DNA对机体健康的影响,研究人员对小鼠机体线粒体的背景进行交换,随后寻找小鼠机体代谢和细胞核基因表达的改变,尤其拥有不同的线粒体DNA序列,以及是机体存在与代谢相关的疾病的易感性差异时。当关闭了线粒体DNA背景后,研究人员将小鼠的饮食从低脂肪转化为高脂肪饮食,随后测定了小鼠机体成分、脂肪组织的代谢和细胞核基因表达的改变。
研究者发现,转换线粒体的遗传背景信息或会明显影响小鼠机体的肥胖、机体整体代谢以及细胞核基因的表达情况。比如,当喂食低脂和高脂饮食后,拥有相同核基因组但不同线粒体DNA背景的小鼠在内脏和皮下脂肪中的基因表达会发生显着的变化,受影响基因的数量变化范围为10-50倍,而且线粒体DNA的背景会影响受影响基因的数量。此外,研究者还发现,小鼠机体体脂的代谢效率和体脂百分比也会受到影响。
比较任何两个人的DNA,你会发现他们的遗传密码中的数百万个位点存在着不同。如今,在一项新的研究中,来自美国拉霍亚免疫学研究所(LJI)的研究人员分享了大量数据,这些数据对于破译这种自然遗传变异如何影响免疫系统保护我们健康的能力至关重要。相关研究结果于近日在线发表在Cell期刊上。
为了确定遗传变异对免疫系统的影响,Vijayanand及其同事们产生了15种类型免疫细胞的基因活性谱,其中这15种类型的免疫细胞发表着在91名健康供者中每个人的血液中发现的最为丰富的细胞类型。他们的研究结果揭示了遗传变异对免疫系统中基因活性的深远影响。对12000多个基因—大约占这些细胞中所有活性基因的60%—而言,天然存在的遗传变异与某些细胞类型中基因活性的显着差异相关。Vijayanand说,”我们观察到的效应大小是令人吃惊的。这不是一些微小变化。”
为了构建这种免疫细胞图谱,Vijayanand团队首先从健康供者的血液样本中分离出不同类型的免疫细胞。他们随后评估了供者特异性的遗传变异,并利用RNA测序确定每种细胞类型中的每个基因的活性水平。这种分析包括了13种类型的免疫细胞。对于其中的两个免疫细胞类型,除了评估处于静息的无活性状态的细胞中的基因活性外,该团队还刺激这些细胞,刺激方式类似于它们在识别病原体或恶性癌细胞时接受到刺激物,随后也在这种激活中分析处于这种激活状态下的基因活性谱。
最终,Vijayanand团队对1500多个样本进行了测序和分析,结果就是产生了大量的数据。通过筛选这些数据,该团队已发现了免疫系统的一些令人吃惊的特征。比如,这些研究人员发现特定类型的免疫细胞中的基因活性在男性和女性之间存在显着差异。此外,他们发现仅在一种细胞类型中,遗传变异通常影响附近基因的表达;因此,这些独特差异在使用全血时可能不会发现到。他们还开始跟进一些有趣的线索,以便研究他们的数据是否揭示了某些与疾病相关的基因发挥的作用。
Wnt信号是一个进化保守的信号途径,在细胞增殖、细胞极性、细胞运动、分化、存活、自我更新和钙平衡方面发挥重要作用。经典Wnt信号是由β-catenin介导的Wnt信号途径,在没有Wnt信号的情况下,细胞内的β-catenin会被由Axin、APC、GSK3和CK1形成的降解复合体降解,Wnt配体能够抑制β-catenin的降解导致β-catenin在细胞核内积累与TCF/LEF家族转录因子形成复合体激活Wnt靶基因的转录。
之前一直认为对于经典Wnt信号途径来说,入核的β-catenin发挥活性主要由TCF/LEF家族转录因子所介导。但是来自瑞士的研究人员利用CRISPR/Cas9基因编辑方法构建了缺少TCF/LEF家族所有四个基因的HEK 293T细胞,发现β-catenin也可以不依赖TCF/LEF转录因子调节靶基因的转录。
在这项研究中,研究人员通过全转录组测序分析发现一部分β-catenin转录靶基因并不需要TCF/LEF转录因子来进行调控。与该结果一致的是,他们在一个全基因组分析中观察到,缺少TCF/LEF的情况下β-catenin仍然能够占据特定的基因区域。研究人员还证实即使缺少TCF/LEF,β-catenin也可以与其他转录因子结合发挥转录活性,并将其称为β-catenin-GHOST反应。
近日,来自美国凯斯西储大学的科学家们通过研究发现,一种特殊的单一蛋白或能调节发育中精子内部一连串关键基因的表达,这种名为Dazl的特殊蛋白能够控制对发育中地精子复制及生存非常必要的多个基因的功能,相关研究结果刊登于国际杂志Cell Reports上,该研究有望帮助开发治疗男性不育的新型疗法。
图片来源:Cell Reports
尽管Dazl能与数千个RNAs结合,但并不是每一种相互作用都是有意义的,其能够结合RNA上的简单序列,即名为G-U-U的三个字符串的碱基,这几乎在几乎所有RNA片段上都会发生,研究者发现,与Dazl相关的G-U-Us高度集中于RNAs上的一个特殊位点,该位点位于几乎所有信使RNAs末端的”polyA尾巴”之前,其或许就是制造蛋白质的模板。
这种高度受限的模式或许就提示,polyA尾巴或许就是Dazl蛋白发生结合作用的关键决定子,其能作为一般传输机制的一部分,将Dazl蛋白装载到不同的mRNAs上,然而仅有一部分与该蛋白结合的RNAs会受到该蛋白的调节,这种运输策略如此之广泛以至于许多RNA都会装载Dazl蛋白,但仅有一小部分RNAs会与该蛋白相互作用引起基因的正向调节表达。在被调节的基因亚群中,很多RNAs都会编码细胞周期蛋白,从而使得Dazl蛋白在精子发育过程中负责调节细胞的增殖。
在一项新的研究中,来自英国威康基金会桑格研究所和欧洲分子生物学实验室(EMBL)欧洲生物信息学研究所等研究机构的研究人员对六种哺乳动物物种中的25万多个细胞的基因进行测序,证实了免疫反应中的基因如何在不同的细胞之间和不同的物种之间具有不同的活活性。相关研究结果于2018年10月24日在线发表在Nature期刊上,论文标题为”Gene expression variability across cells and species shapes innate immunity”。
这些研究人员证实这些基因在不同的物种之间快速地进化,而且在单个组织内的不同细胞中也具有高度可变的活性。相比之下,他们发现在不同物种之间保守的并调节免疫反应的基因在单个组织的不同细胞之间中更加一致性地被激活。这些基因可能受到更严格的限制,这是因为它们参与细胞内的许多不同功能。但是,它们也是病毒的靶标。这些受到更严格限制的基因代表着致命弱点,可被病原体用来破坏免疫系统。
论文第一作者、威康基金会桑格研究所研究员Tzachi Hagai博士说,”我们认为这种激活模式—一些基因受到严格控制,而另一些基因具有更多的可变活性—已进化成了一种对先天性免疫反应加以微调的方式。它是高效的,但又是平衡的。基因能够经进化后协助细胞控制入侵者,而且对这些基因的使用能够因细胞而异,因此周围组织不会受到大量攻击的影响。”
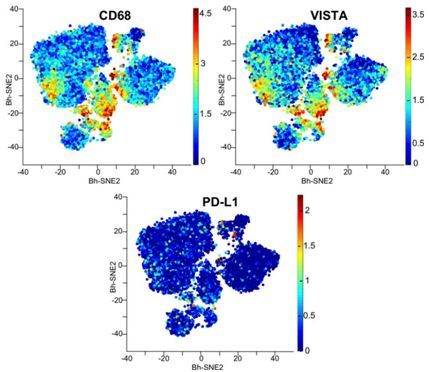
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员鉴定出一个潜在新的免疫治疗靶标。他们发现免疫检查点VISTA在浸润到胰腺瘤中的免疫细胞(特别是巨噬细胞)中过量表达。相关研究结果于近日在线发表在PNAS期刊上。
图片来源:PNAS
在这项新的研究中,Sharma和Allison及其团队通过比较胰腺瘤和对免疫检查点阻断药物治疗最为敏感的黑色素瘤,着手阐明免疫细胞浸润以及免疫抑制性的免疫检查点在胰腺癌中的表达。他们首先分析了23例外科手术切除下来的未经治疗的胰腺癌肿瘤中的9个免疫抑制基因的表达,发现这些表达结果将胰腺癌患者分为两组,其中11例具有高表达的免疫抑制基因(即高表达组),12例具有低表达的免疫抑制基因(即低表达组)。低表达组的中位生存期为37个月,而高表达组的中位生存期为20个月,这表明对总体存活存在潜在的免疫影响。
通过分析29例未经治疗的胰腺癌肿瘤和44例未经治疗的黑色素瘤,这些研究人员发现攻击性的T细胞更高地浸润到黑色素瘤中,以及更高水平的免疫细胞表达免疫抑制性的免疫检查点分子PD-1及其活化配体PD-L1,免疫检查点阻断药物可成功地通过靶向这两种免疫检查点分子来治疗黑色素瘤。然而,胰腺瘤具有更高的VISTA表达。在大约三分之一的胰腺瘤中,T细胞浸润率大致与黑色素瘤中的相同,但是它们主要聚集在这种肿瘤的基质细胞而不是恶性肿瘤细胞附近,然而,在黑色素瘤中,它们均匀地分布在恶性肿瘤细胞和基质细胞之间。对这些研究人员来说,这是有道理的。Sharma说,”在胰腺癌中,肿瘤中的基质细胞比恶性肿瘤细胞多得多。为什么会这样?我认为这就是这种肿瘤的生长方式。”Allison注意到在胰腺癌中,基质细胞可能让T细胞远离癌细胞。
通过单独比较三种类型的胰腺瘤—未经治疗的原发性胰腺瘤、经过治疗的转移性胰腺瘤和在外科手术切除前事先经过治疗的原发性胰腺瘤,这些研究人员发现转移性胰腺瘤中存在较低的T细胞浸润率,而在未经治疗的原发性胰腺瘤和经过治疗的转移性肿瘤中存在着更高水平的VISTA。对7例胰腺样本的分析发现CD68阳性巨噬细胞具有不同的各自抑制免疫反应的PD-L1和VISTA通路。对来自三名转移性胰腺癌患者的肿瘤中获取的T细胞进行的实验表明当进行PD-L1抑制时,有活性的VISTA通路更大程度地降低这种肿瘤中的活性T细胞反应。这表明利用PD-1/PD-L1抑制剂治疗胰腺癌可能遭遇失败的原因在于未经治疗的VISTA通路仍然抑制T细胞免疫反应。(生物谷Bioon.com)
 基因君官网
基因君官网